
ілюстрація Маккол Сарретт
Будь то забуття 20 років вашого життя або ведення однієї і тієї ж розмови кожні п’ять хвилин, лише щоб це забути кожного разу, погіршення пам’яті може сильно вплинути на повсякденне життя. Це може бути одним із найбільш заплутаних аспектів нейродегенерації та ключовим симптомом деменції.
Хвороба Альцгеймера, також відомий як AD, є найпоширенішою формою деменції, що характеризується когнітивними труднощами та втратою пам'яті. В даний час офіційної клінічної методики діагностики АД, окрім розтину, не існує. Однак є дві характерні особливості мозкової тканини хворих на хворобу Альцгеймера: амілоїд бета (А?) бляшки та нейрофібрилярні клубки, обидва з яких дали значну інформацію про патологію нейродегенерації.
"Нейрофібрилярні клубки виникають внаслідок дефекту білків, який називається білками тау".
А? це білок, який є результатом протеоліз of Білок-попередник амілоїду (APP). Це означає, що APP розрізано на менші фрагменти, один із яких A? фрагмент. АРР розрізається на ці частини ферментами, які називаються секретазами, основна роль яких полягає в розщепленні цих білків. Існують різні секретази, але є одна, важлива для патології Альцгеймера – гамма-секретаза. Гамма-секретаза виробляє особливу форму A?: A?-42, найбільш токсичну форму білка. Після розпаду ці білкові фрагменти починають збиратися в просторі поза клітинами. Ключ до токсичності цих білків полягає в тому, що вони є «липкими», тому починають утворювати агрегати. Ці агрегати продовжують розвиватися, і незабаром ці бета-амілоїдні бляшки є скрізь, значно погіршуючи функцію нейронів.
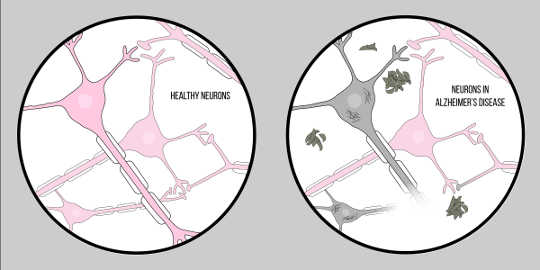 Малюнок Маккол Сарретт
Малюнок Маккол Сарретт
Цей вплив A? на неврологічну функцію призвело до Гіпотеза про амілоїд, добре відома теорія, що пропонує пояснення нейродегенерації при хворобі Альцгеймера.
Тепер щодо другої ключової характеристики: нейрофібрилярні клубки. Нейрофібрилярні клубки виникають внаслідок дефекту білків, який називається білками тау. Білки тау служать містком між структурами, які називаються мікротрубочками всередині клітини. Мікротрубочки є підтримуючими молекулами, які забезпечують форму та структуру клітин, зокрема, аксонів. Білки тау допомагають цим мікротрубочкам забезпечувати структуру аксонів. Однак у випадку з Хвороба АльцгеймераНейродегенеративне захворювання, що характеризується втратою нейронів i ..., білки тау відокремлюються і накопичуються в клітинному тілі, інакше відоме як сома. Це спричиняє дегенерацію аксонів, що ще більше ускладнює зв'язок нейронів. Ця складність у взаємодії нейронів подібна до ефектів амілоїду бета; однак важливо зазначити, що ці сплутування сильно відрізняються від обговорених раніше бляшок тим, що вони впливають на спілкування зсередини клітини, на відміну від зовнішньої.
"Вчені досі не впевнені, який саме механізм відповідає за патологію Альцгеймера".
Хоча обидва надзвичайно впливові, А? і тау не є єдиними важливими факторами, коли йдеться про патологію хвороби Альцгеймера. Дослідження показали, що аполіпопротеїн Е (APOE) ген може бути таким же впливовим, як A?. Існує три основні варіанти, які кодують білки: ApoE2, ApoE3 і ApoE4. Було показано, що ApoE4 корелює зі зменшенням синаптичного скорочення, тоді як ApoE2 призводить до збільшення. Обидві форми впливають астроцити (важливо гліальні клітини в нервовій системі) і співвідносяться із швидкістю фагоцитозу, процесом, за допомогою якого астроцитиГліальні клітини зіркоподібної форми, які виконують ряд функцій, включаючи ... поглинають клітинний матеріал. Кожен варіант ApoE безпосередньо впливає на цю швидкість фагоцитозу, ApoE2, що призводить до збільшення, а ApoE4 - зменшення. Це свідчить про те, що астроцити можуть бути менш здатними «очищати» уламки, що плавають навколо клітини, коли вони співвідносяться з ApoE4. Таким чином, коли ці бляшки накопичуються, генотип ApoE4 може перешкоджати очищенню цих агрегатів, сприяючи дегенерації.
Амілоїд-бета, тау та різні гени працюють разом, щоб викликати серйозну проблему спілкування між клітинами, що, по суті, є хворобою, яку ми знаємо як хворобу Альцгеймера. Така нейродегенерація найчастіше зустрічається в областях мозку, пов’язаних із навчанням і пам’яттю, але з часом поширюється по всьому мозку. З цією відсутністю спілкування відбувається втрата синапсів і, врешті-решт, зменшення речовини мозку. Таким чином, нормально спостерігати зменшення мозкової тканини на МРТМагнітно-резонансна томографія, техніка для перегляду струк ... по мірі прогресування захворювання, виявляючи, що хвороба Альцгеймера буквально зменшує мозок. Наші сучасні моделі навчання та пам’яті стверджують, що синапси відіграють ключову роль у цих процесах, надаючи можливе пояснення того, як ця патологія співвідноситься з основними симптомами БА, такими як втрата пам’яті.
Вчені досі не впевнені, який саме механізм відповідає за патологію Альцгеймера. Багато інноваційних методів досліджено, намагаючись отримати подальші знання щодо цієї патологічної точки, серед яких є біомаркери ліквору (ліквору).
Рівні A? і тау можна виміряти в лікворі за допомогою процедури, яка називається люмбальна пункція, під час якої збирається спинномозкова рідина. Підвищені рівні тау та знижені рівні A? спостерігаються у пацієнтів із хворобою Альцгеймера. Це результат А? накопичення в мозку, що, у свою чергу, призводить до зниження концентрації в ЦСР. Ці дані свідчать про те, що в майбутньому лікарі та вчені зможуть передбачити когнітивний стан пацієнта, досліджуючи рівень білка в спинномозковій рідині.
В даний час остаточного ліки від хвороби Альцгеймера не існує. Проте збільшення знань про патологічні білки, пов'язані з ними гени, та постійні наукові дослідження дають надію на ефективне лікування в майбутньому.
Як ви вважаєте, який прорив необхідний медицині для лікування хвороби Альцгеймера? Повідомте нас у коментарях!
Ця стаття спочатку з'явилася на Знаючи нейронів?
про автора
Хайла Блек - першокурсниця Нью-Йоркського університету в Шанхаї, яка планує оголосити спеціальність з нейронних наук, а другою - в галузі наук про дані, з концентрацією в галузі штучного інтелекту. У майбутньому вона сподівається здобути ступінь доктора медицини / доктора філософії та стати неврологом, який вивчає молекулярні аспекти навчання та пам’яті. У вільний час Хайла із задоволенням працює з ініціативою MYELIN в рамках IYNA, а також читає будь-які матеріали, що стосуються неврології. Поза вивченням неврології вона любить бігати, викладати в місцевих початкових школах, вирішувати математичні завдання та пити величезну кількість кави.
Суміжні книги
at InnerSelf Market і Amazon
посилання
Лакор, П.Н., Буньєл, М.С., Ферлоу, П.В., Клементе, А.С., Веласко, П.Т., Вуд, М., . . . Klein, WL (2007, 24 січня). А? Аберації, спричинені олігомерами Синапс Склад, форма та щільність забезпечують молекулярну основу для втрати зв’язку при хворобі Альцгеймера. Отримано з http://www.jneurosci.org/content/27/4/796
Мерфі, М.П., ЛеВайн, Х. (2010). Хвороба Альцгеймера і β-амілоїдний пептид. Журнал хвороби Альцгеймера?: JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ, & Wong, PC (2011). Обробка білка-попередника амілоїду та хвороба Альцгеймера. Щорічний огляд неврології, 34, 185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD,… Barres, BA (2016). Нова залежна роль алелю від APOE у контролі швидкості синапсЗв'язки між нейронами, де сигнал передається від ... обрізання астроцитами. Праці Національної академії наук Сполучених Штатів Америки, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009, 19 серпня). Амілоїд ? і АРР як біомаркери для хвороби Альцгеймера. Отримано з https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























